Cómo saber cuál es el reactivo limitante
Cómo saber cuál es el reactivo limitante. La química es una ciencia fascinante que nos permite entender y manipular los procesos que ocurren a nuestro alrededor. Si tienes alguna inquietud recuerda contactarnos a través de nuestras redes sociales, o regístrate y déjanos un comentario en esta página. También puedes participar en el WhatsApp. Si usas Telegram ingresa al siguiente enlace.
Uno de los conceptos fundamentales de la química es el de reacción química, que es la transformación de unas sustancias, llamadas reactivos, en otras sustancias diferentes, llamadas productos.
En este proceso, los reactivos interactúan entre sí en proporciones definidas por la estequiometría de la reacción.
En muchas ocasiones, es importante saber cuál es el reactivo limitante en una reacción química. El reactivo limitante es aquel que se consume por completo durante la reacción, lo que determina la cantidad máxima de productos que se pueden obtener.
En este artículo, explicaremos cómo podemos saber cuál es el reactivo limitante en una reacción química.
¿Qué es el reactivo limitante?
Antes de explicar cómo podemos determinar cuál es el reactivo limitante en una reacción química, es importante entender qué es el reactivo limitante.
El reactivo limitante es aquel que se consume completamente durante la reacción, lo que significa que determina la cantidad máxima de productos que se pueden obtener.
Por otro lado, el reactivo en exceso es aquel que queda después de que se haya consumido todo el reactivo limitante.
Para entender mejor este concepto, veamos un ejemplo. Supongamos que queremos producir agua a partir de hidrógeno y oxígeno, según la siguiente reacción:
2H2 + O2 → 2H2O
En esta reacción, el hidrógeno y el oxígeno son los reactivos, y el agua es el producto. La estequiometría de la reacción indica que se necesitan dos moléculas de hidrógeno por cada molécula de oxígeno para producir dos moléculas de agua.
Si tenemos 4 moléculas de hidrógeno y 2 moléculas de oxígeno, ¿cuál es el reactivo limitante y cuál es el reactivo en exceso? Para responder esta pregunta, podemos calcular cuántas moléculas de agua se pueden producir con cada reactivo:
- Con 4 moléculas de hidrógeno: 4 moléculas de H2 x (2 moléculas de H2O / 2 moléculas de H2) = 4 moléculas de H2O
- Con 2 moléculas de oxígeno: 2 moléculas de O2 x (2 moléculas de H2O / 1 molécula de O2) = 4 moléculas de H2O
- Como podemos ver, ambos reactantes pueden producir la misma cantidad de agua, por lo que ninguno de ellos es el reactivo limitante. Sin embargo, si tuviéramos solo 2 moléculas de hidrógeno y 2 moléculas de oxígeno, el cálculo sería diferente:
- Con 2 moléculas de hidrógeno: 2 moléculas de H2 x (2 moléculas de H2O / 2 moléculas de H2) = 2 moléculas de H2O
- Con 2 moléculas de oxígeno: 2 moléculas de O2 x (2 moléculas de H2O / 1 molécula de O2) = 4 moléculas de H2O
- Como podemos ver, en este caso el reactivo limitante es el hidrógeno, ya que solo se pueden producir 2 moléculas de agua con las 2 moléculas de hidrógeno disponibles. El oxígeno es el reactivo en exceso, ya que sobran 2 moléculas después de la reacción.
¿Cómo determinar el reactivo limitante?
Existen varias formas de determinar cuál es el reactivo limitante en una reacción química, pero una de las más sencillas es comparar las cantidades de cada reactivo con la estequiometría de la reacción.
La estequiometría de la reacción nos indica en qué proporción se combinan los reactivos y se producen los productos, por lo que si conocemos las cantidades de los reactivos podemos calcular cuál de ellos se consumirá completamente.
Para hacer este cálculo, es necesario convertir las cantidades de los reactivos a moles, que es la unidad de medida que se utiliza en química para expresar la cantidad de sustancia.
Para ello, es necesario conocer la masa molecular de cada reactivo, que se expresa en gramos por mol. Una vez que tenemos las cantidades de los reactivos en moles, podemos compararlas con la estequiometría de la reacción para determinar cuál es el reactivo limitante.
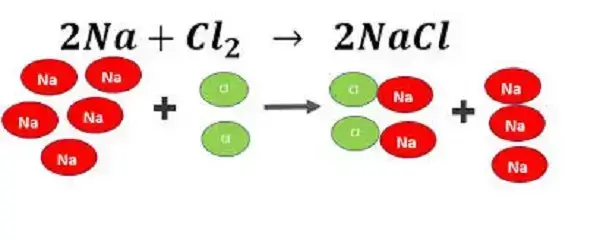
Veamos un ejemplo. Supongamos que queremos producir cloruro de sodio a partir de cloro y sodio, según la siguiente reacción:
2Na + Cl2 → 2NaCl
Si tenemos 3 gramos de sodio y 5 gramos de cloro, ¿cuál es el reactivo limitante y cuál es el reactivo en exceso?
Para hacer este cálculo, primero debemos convertir las cantidades de cada reactivo a moles, utilizando su masa molecular:
Sodio: 3 g / 23 g/mol = 0.13 moles
Cloro: 5 g / 71 g/mol = 0.07 moles
Luego, podemos comparar estas cantidades con la estequiometría de la reacción, que indica que se necesitan 2 moles de sodio por cada mol de cloro para producir 2 moles de cloruro de sodio.
Como podemos ver, la cantidad de cloro es menor que la cantidad de sodio, lo que significa que el cloro es el reactivo limitante y el sodio es el reactivo en exceso.
¿Por qué es importante conocer el reactivo limitante?
Conocer cuál es el reactivo limitante en una reacción química es importante por varias razones. En primer lugar, nos permite calcular la cantidad máxima de productos que se pueden obtener a partir de una cantidad determinada de reactivos.
Si no conocemos cuál es el reactivo limitante, es posible que estemos desperdiciando reactivos o que no estemos obteniendo la cantidad máxima de productos posibles.
Además, conocer el reactivo limitante nos permite optimizar el proceso de producción y reducir los costos. Si sabemos cuál es el reactivo limitante, podemos ajustar las cantidades de reactivos para obtener la cantidad deseada de productos de manera más eficiente y con menor desperdicio.
Por último, el conocimiento del reactivo limitante es importante para entender las reacciones químicas y los procesos que ocurren en la naturaleza y en
la industria. Muchos procesos químicos dependen del conocimiento del reactivo limitante para su diseño y optimización, por lo que es un concepto fundamental para cualquier persona que trabaje en el campo de la química o de la ingeniería química.
Preguntas frecuentes
¿Qué pasa si añado más reactivo después de que se haya consumido el reactivo limitante?
Si añades más reactivo después de que se haya consumido el reactivo limitante, este reactivo no reaccionará y quedará en exceso. Esto puede aumentar los costos y reducir el rendimiento del proceso, ya que estarás añadiendo reactivo que no contribuirá a la producción de productos.
¿Cómo puedo saber cuántos productos se pueden obtener a partir de una cantidad determinada de reactivo?
Para saber cuántos productos se pueden obtener a partir de una cantidad determinada de reactivo, primero debes determinar cuál es el reactivo limitante. Luego, debes calcular la cantidad de productos que se pueden obtener utilizando la cantidad de reactivo limitante. Si hay reactivo en exceso, debes calcular cuántos productos adicionales se pueden obtener con el reactivo en exceso.
¿Cómo puedo saber cuánto reactivo necesito para obtener una cantidad determinada de productos?
Para saber cuánto reactivo necesitas para obtener una cantidad determinada de productos, debes conocer la estequiometría de la reacción y la cantidad de productos que deseas obtener. A partir de ahí, puedes calcular cuánto reactivo necesitas utilizando proporciones y reglas de tres simples.
Conclusión
En resumen, el reactivo limitante es aquel que se consume completamente durante una reacción química y determina la cantidad máxima de productos que se pueden obtener.
Para determinar cuál es el reactivo limitante en una reacción química, es necesario comparar las cantidades de cada reactivo con la estequiometría de la reacción y convertirlas a moles.
Conocer el reactivo limitante es importante para calcular la cantidad máxima de productos que se pueden obtener, optimizar el proceso de producción y entender las reacciones químicas en general.
Siempre debemos tener en cuenta este concepto fundamental en la química para poder realizar cálculos precisos y eficientes en cualquier proceso que involucre reacciones químicas.